保留乳房手术联合放疗是许多早期乳腺癌患者的首选治疗方式。传统术后放疗(postoperative radiotherapy,PORT)是全乳及瘤床加量的外照射治疗,可显著降低早期乳腺癌的局部复发[1]。但PORT存在疗程长、花费高、并发症多等缺点,使21%患者在保乳手术后而放弃PORT[2]。研究发现80%~90%的局部复发位于瘤床或其周围[3]。加速部分乳房照射(accelerated partial breast irradiation,APBI)逐渐用于代替PORT以减少照射剂量、面积和时间。术中放疗(intraoperative radiotherapy,IORT)作为APBI技术之一,在手术中直接对瘤床进行一定剂量的单次照射,大大缩短了放疗时间,也减少了对正常乳腺组织和邻近器官的损伤。多项研究已表明IORT和PORT在总生存(overall survival, OS)上相近,但IORT可能比PORT有更高的复发风险,因此IORT在早期乳腺癌中的应用仍有争议[4,5,6]。美国放射肿瘤学会建议50岁以下、肿瘤较大及淋巴结阳性等高复发风险患者应谨慎或不适合进行APBI[7,8]。本文重点研究在低复发风险(≥50岁、肿瘤≤3 cm、淋巴结阴性)的早期女性乳腺癌患者中IORT和PORT对研究人群OS和乳腺癌特异性生存(breast cancer-specific survival,BCSS)的影响并分析影响预后的因素。

1.临床资料:
从SEER数据库(SEER*Stat 8.3.6版本)中收集自2010年1月1日至2015年12月31日诊断为乳腺癌的患者资料,共379 100例。收集临床信息包括诊断时间、年龄、性别、种族、肿瘤大小、淋巴结状态、远处转移情况、组织学分级[国际肿瘤疾病分类2(ICD-O-2)Ⅰ-Ⅳ级]、病理类型、T分期(AJCC第7版分期指南)、手术方式、放疗方式、雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)状态、化疗情况、随访时间、OS、BCSS。纳入标准为女性、≥50岁、浸润性乳腺癌、肿瘤≤3 cm、淋巴结无转移、无远处转移、保乳手术、行单次IORT和PORT。临床信息不详及无完整的随访数据的予以排除。根据放疗方式将患者分为IORT组和PORT组。
2.统计方法:
应用SPSS 22.0软件对分类变量用频率和比例表示,连续变量用中位数和四分位间距来描述。采用χ2检验比较各组间分类变量。通过Kaplan-Meier曲线获取两组OS和BCSS。利用Cox模型单因素分析找到影响预后的有意义因素,估算HR和95%CI,并将有意义因素引入多因素分析,估算调整HR (aHR)和95%CI,得到影响预后的独立危险因素。从诊断时间、年龄、种族、组织学分级、病理类型、T分期、ER、PR、HER2、化疗变量进行IORT∶PORT=1∶4倾向得分匹配(propensity score matching,PSM)。P<0.05为差异有统计学意义。

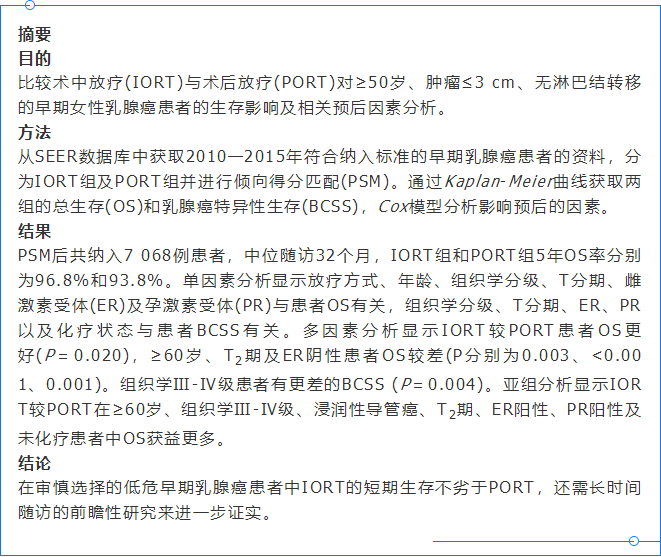
1.PSM前后患者临床特征:
PSM前共78 938例患者符合纳入条件,IORT组1 414例(1.79%),PORT组77 524例(98.21%)。PSM后共纳7 068例患者,其中IORT组1 414例(20.0%),PORT组5 654例(80.0%),两组中位随访时间分别为32.0(20.0~46.0)个月和32.0(20.0~45.0)个月。PSM前后患者详细临床特征分布见表1。PSM前患者中两组在各临床特征方面均存在显著分布差异,PSM后两组在各临床因素上匹配良好。PSM后的女性中大多数为年龄≥60岁、白人、浸润性导管癌、组织学分级Ⅰ-Ⅱ级、T1期、ER阳性、PR阳性、HER2阴性、已化疗。
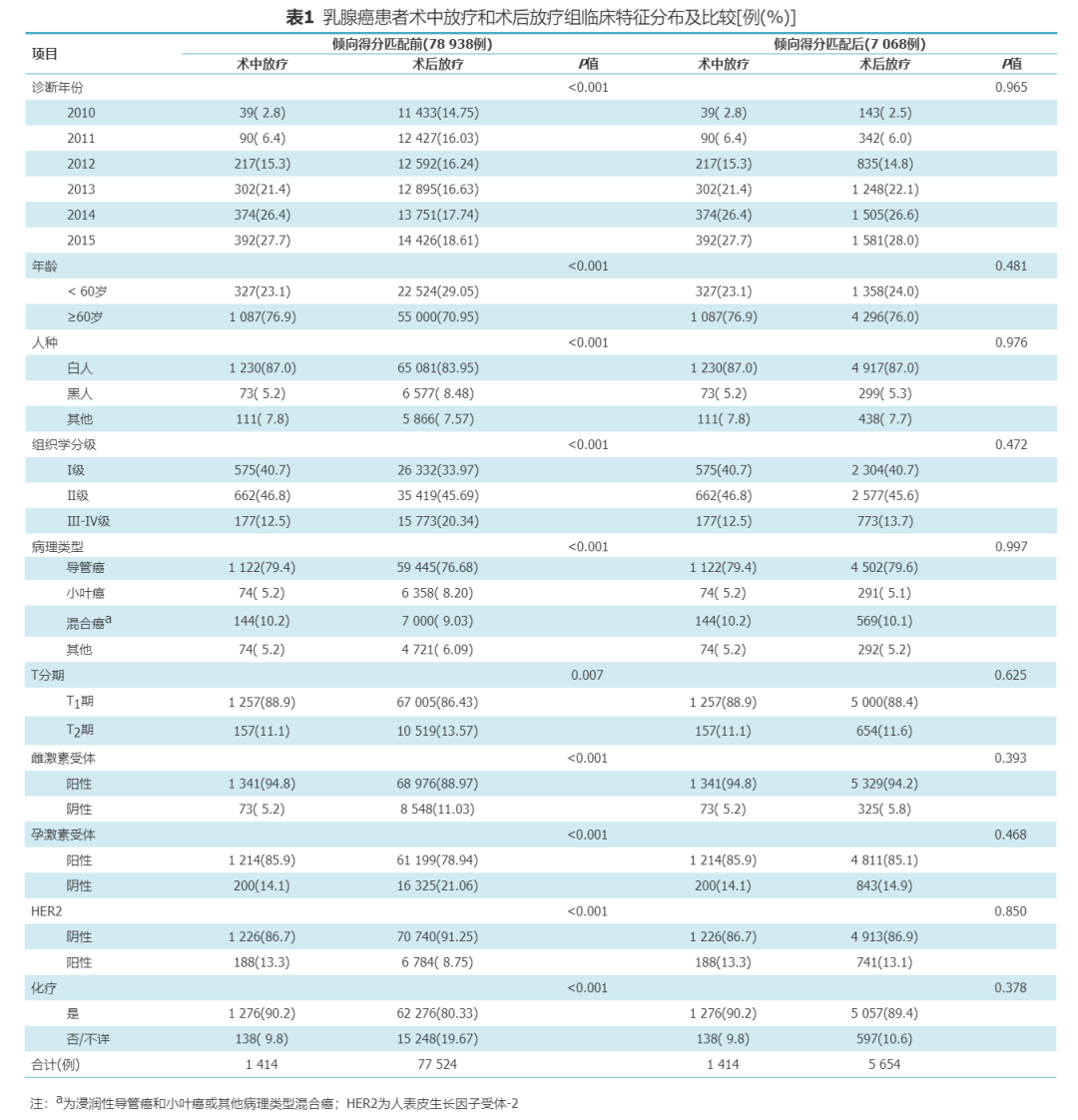
2.IORT和PORT患者的生存差异分析:
PSM前IORT组和PORT组5年OS率分别为96.8%和93.4%,5年BCSS率分别为98.9%和98.6%。PSM后IORT组和PORT组5年OS率分别为96.8%和93.8%,5年BCSS率分别为98.9%和99.0%。PSM后单因素分析显示IORT组较PORT组患者OS获益(HR=0.62,95%CI为0.41~0.94,P=0.025),BCSS相近(HR=0.64,95%CI为0.22~1.83,P=0.400),余详见表2。多因素分析亦为相同结果(OS:aHR=0.61,95%CI为0.41~0.93,P=0.020;BCSS:aHR=0.62,95%CI为0.22~1.78,P=0.377),详见表2。
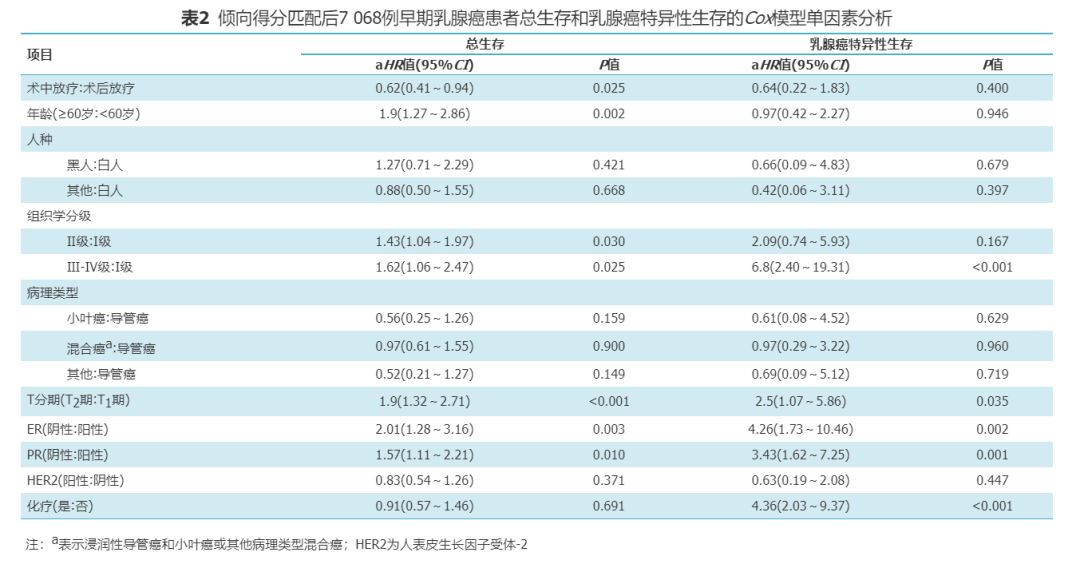
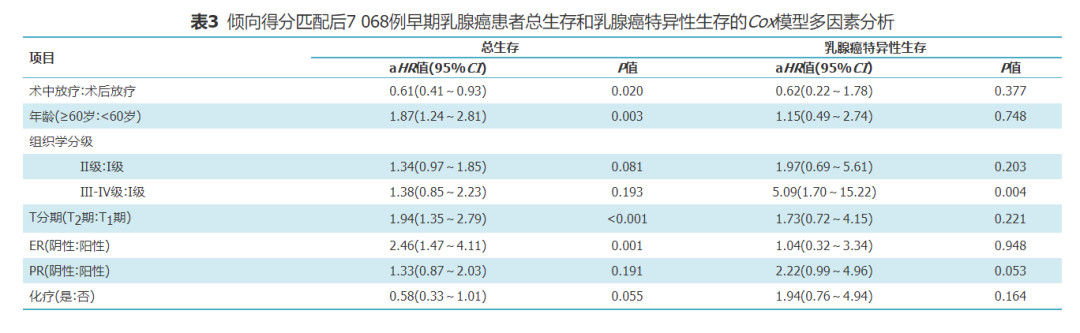
3.PSM后影响早期乳腺癌预后因素分析:
单因素分析显示放疗方式、年龄、组织学分级、T分期、ER及PR与OS有关;人种、组织学分类、HER2及化疗与否与OS无关;组织学分级、T分期、ER、PR以及化疗状态与研究患者的BCSS有关;放疗方式、年龄、种族、组织学分类及HER2状态与BCSS无关(表2)。多因素分析显显示IORT (aHR=0.61;95%CI为0.41~0.93,P=0.020)患者有更好的OS,≥60岁(aHR=1.87;95%CI为1.24~2.81,P=0.003)、T2期(aHR=1.94,95%CI为1.35~2.79,P<0.001)及ER阴性(aHR=2.46,95%CI为1.47~4.11,P=0.001)患者有较差OS。组织学Ⅲ-Ⅳ级(aHR=5.09,95%CI为1.70~15.22,P=0.004)患者有更差BCSS (表3)。
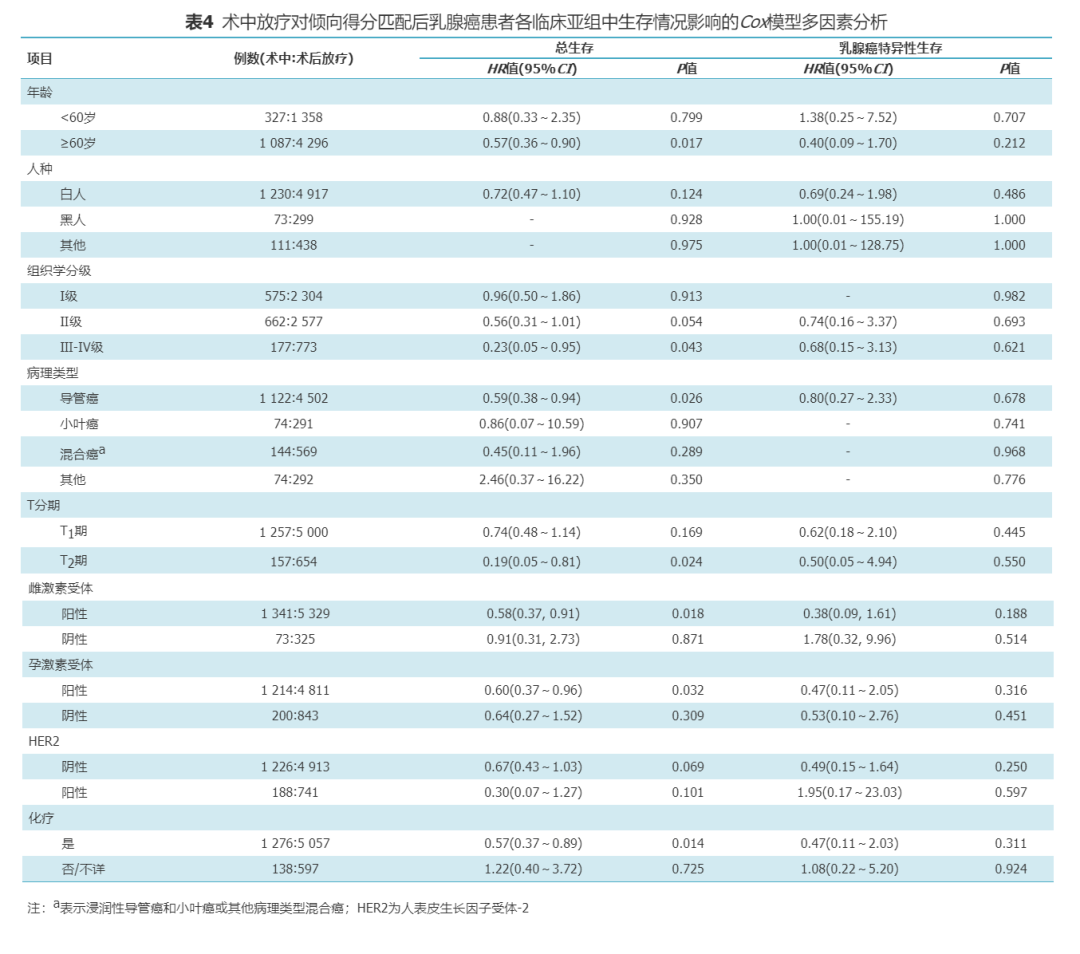
4.PSM后各临床亚组中放疗方式对生存影响的分析:
亚组分析示,IORT较PORT在≥60岁(P=0.017)、组织学Ⅲ-Ⅳ级(P=0.043)、浸润性导管癌(P=0.026)、T2期(P=0.024)、ER阳性(P=0.018)、PR阳性(P=0.032)及未化疗(P=0.014)亚组患者中OS获益更多,在其他临床亚组中OS差异无统计学意义(表4)。此外,在各临床亚组中IORT和PORT患者的BCSS相似(表4)。
03讨 论
乳腺癌是全世界女性中最常见的肿瘤疾病。据估计,2020年美国将出现女性乳腺癌276 480例新病例和42 170例死亡病例[9]。先进的检查技术使越来越多的早期乳腺癌可以得到系统的诊断和治疗,目前乳腺癌的10年生存率在85%左右[10]。随着IORT设备的引进和应用,保乳手术联合IORT因能最大限度减少患者的不便和利用医疗资源而显示出良好的应用前景。
许多研究已经证实了IORT相对PORT对早期乳腺癌患者OS获益的非劣效性[4,5]。除此之外,IORT在美容效果、花费、生活质量等方面更优于PORT,提高了患者的依从性[11,12]。虽然研究也显示IORT可能导致更高的局部复发率[4,5],但越来越多的证据表明IORT可能是低危早期乳腺癌患者的一种可替代放疗方式[13,14]。有研究显示IORT可以直接靶向瘤床,有效改变局部微环境,降低局部肿瘤复发的风险[15]。最近的一项研究表明,对于高度选择的早期低危乳腺癌患者,IORT1年和5年的局部无复发生存率分别为100%和95.2%[16]。
TARGIT-A试验的长期生存和局制结局更显示出,对于乳腺浸润性导管癌年龄≥45岁、肿瘤≤3.5 cm、N0-N1期、符合保乳手术标准的女性,在预设非劣效临界值相差2.5%时,单次IORT较全乳PORT的5年局部复发率相近,在中位8.6年的随访后两组局部复发风险相似(P=0.28),BCSS相似(P=0.54),其他原因死亡风险IORT较PORT低(HR=0.59;95%CI为0.40~0.86,P=0.005),说明对于低危的早期乳腺癌保乳手术患者进行单次靶向IORT较全乳PORT毫不逊色[17]。
虽然目前还没有公认的乳腺癌患者IORT治疗指南,但美国放射肿瘤学会指南[7,8]、欧洲放疗和肿瘤学协会[18]、美国近距离治疗学会[19]均建议选择中低风险的患者进行APBI,其中美国放射肿瘤学会指南对患者选择的限制最为严格。本研究基于美国放射肿瘤学会指南和SEER数据库,比较在≥50岁、肿瘤≤3 cm、淋巴结阴性的低危早期女性乳腺癌患者中IORT和PORT对生存的影响并分析影响预后的相关因素。我们发现在短期随访内,接受IORT的患者BCSS不劣于PORT患者,这与既往研究一致[4,5,6]。而OS优于接受PORT患者,原因可能与IORT较低的急性或晚期放射性不良反应对心肺功能较差的老年患者有好处[20,21],结论仍需长期随访加以验证。我们也发现年龄、T分期、ER状态与OS有关,组织学分级与BCSS有关,这与Lei等[6]的研究相似。亚组分析示:IORT较PORT在≥60岁、组织学Ⅲ-Ⅳ级、浸润性导管癌、T2期、ER阳性、PR阳性及未化疗患者中OS获益更多。有研究显示,IORT和PORT在HR阴性/HER2阴性或HER2阳性的乳腺癌患者中OS和无病生存率没有显著差异[22],这与我们的结果一致。TARGIT-A和ELIOT试验的亚组分析也表明HR阳性,尤其是PR阳性患者可能更适合IORT。在ELIOT试验中,肿瘤大小(≥2 cm)、低分化肿瘤、阳性淋巴结(≥4)和HR阴性/HER2阴性亚型等因素可能导致接受IORT的患者5年内局部复发率更高[5]。对于高危患者,IORT作为瘤床补量放疗显示出良好的局部控制率,是高效、安全的方法[23,24]。
SEER数据库是最大的公开癌症数据集,我们从大样本多机构的早期乳腺癌患者中收集信息。为了减少混杂因素的影响,我们进行了PSM以确保结果更准确。然而,本研究存在基于SEER数据库的分析存在固有的缺点:①本研究是回顾性研究,也缺乏一些重要的临床信息,如Ki-67、2010年前的患者HER-2状态、辅助和新辅助治疗、内分泌治疗等信息;②比较术中和PORT的局部复发率是很重要的,但数据库中至今未公布此信息,致使无法分析;③随访时间仍较短,需要更长时间的随访来进一步证实结论。
综上所述,本研究表明,在高度筛选的早期乳腺癌患者中,IORT的短期OS和BCSS不劣于术后全乳放疗,对适合的低危保乳患者应予以考虑应用IORT。对于审慎选择的患者,IORT是一种合理的替代PORT的方法。
利益冲突 所有作者声明不存在利益冲突
参考文献
ReintgenC, ReintgenD, SolinLJ. Advances in local-regional treatment for patients with early-stage breast cancer:a review of the field[J]. Clin Breast Cancer, 2010, 10(3):180-187. DOI:10.3816/CBC.2010.n.025.
TuttleTM, JarosekS, HabermannEB, et al. Omission of radiation therapy after breast-conserving surgery in the United States:a population-based analysis of clinicopathologic factors[J]. Cancer, 2012, 118(8):2004-2013. DOI:10.1002/cncr.26505.
KulcentyK, PiotrowskiI, RucinskiM, et al. Surgical wound fluids from patients with breast cancer reveal similarities in the biological response induced by intraoperative radiation therapy and the radiation-induced bystander effect-transcriptomic approach[J]. Int J Mol Sci, 2020, 21(3):1159. DOI:10.3390/ijms21031159.
VeronesiU, OrecchiaR, MaisonneuveP, et al. Intraoperative radiotherapy versus external r




