2022年6月9日,来自以色列特拉维夫大学大学生命科学学院的Adi Barzel团队在Nature Biotechnology上发表题为In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice的研究性文章,提出了使用两种腺相关病毒载体进行的体内B细胞工程,该工程可成功编辑B细胞,并导致其记忆保持和具有高中和滴度的抗HIV bNAb(broadly neutralizing antibodies,广泛中和抗体)的分泌,是一种安全、有效和可扩展的治疗HIV的方法。 
针对HIV的广泛中和抗体(bNAbs)可以抑制病毒血症。过去的研究表明两种bNAbs,即3BNC117和10-1074的联合治疗可以维持患者对HIV的抑制。然而,这两种bNAbs的平均半衰期分别为16天和23天,允许了病毒的反弹。有限的bNAb持久性可以通过病毒载体转导后肌肉的结构性表达来解决,然而,不正确的糖基化可能产生抗药抗体。并且可能由于为了长期抑制多样化和不断演变的艾滋病毒,肌肉表达的抗体不经历类别转换重组(CSR)或亲和力成熟。
为此,人们开发了用于抗体表达的B细胞工程。其中,Toll样受体(Toll-like Receptor,TLR)介导的B细胞体外激活与体内Prime-Boost免疫相结合,证明了工程化B细胞具有免疫记忆、CSR、体细胞高突变(SHM)和克隆选择功能。然而,体外B细胞工程的成本较高且操作复杂,同种异形B细胞的移植也颇具挑战性。为解决上述问题,本文团队通过体内基因编辑的技术,使工程B细胞在经历抗原诱导的激活后,可记忆保留、克隆选择和分化为浆细胞,并分泌中和水平的bNAb。该方法更加简单、快速、经济,在未来也可能被用来治疗其他持续性感染以及自身免疫性疾病、遗传疾病和癌症。
首先,为促进体内B细胞工程,研究人员使用了一对AAV-DJ载体、其中一个编码金黄色葡萄球菌Cas9(saCas9),另一个编码3BNC117抗HIV bNAb。在第一组实验中,saCas9是从活性巨细胞病毒(CMV)启动子表达的,sgRNA被编码在同一AAV上以靶向saCas9到免疫球蛋白重基因座(IgH)位点。反过来,bNAb被编码为一个双顺反子,在依赖于IgH增强子的启动子的控制下表达,其两侧有同源臂,用于整合到IgH基因座的J-C内含子中的saCas9切割位点。bNAb包括完整的轻链和重链的可变段(VL以及VH),并由编码Furin切割位点和2A-肽的序列分隔。剪接供体序列跟随VH基因片段,允许其与恒定的IgH外显子融合,整合到基因座上,并随后转录和剪接。该设计有助于破坏内源性IgH基因座和初始bNAb表达。这允许随后在抗原结合时激活工程B细胞,从而导致分化为记忆和浆细胞(图一)。
图一:基因工程编辑体内B细胞过程
由于有效的AAV转导需要B细胞的激活,工程B细胞的后续激活信号可能受益于先前启动的T辅助细胞和滤泡树突状细胞呈递适当的免疫复合体。因此,在给小鼠注射AAV之前,要进行预先免疫,模拟先前存在的感染。研究人员用20微克的gp120(3BNC117的靶标) HIV抗原免疫C57BL/6小鼠。在免疫后第6天,每只小鼠注射bNAb编码(供体)载体的病毒基因组(VG)和/或saCas9编码载体的VG。研究发现,同时接受供体载体和saCas9载体的小鼠血液中有高含量的3BNC117 bNAb,比只注射供体载体的小鼠有更高的3BNC117滴度。酶联免疫吸附点(ELISPOT)也证实了骨髓中3BNC117分泌细胞的存在,并且这与小鼠的脾3BNC117表达有很好的相关性。综上,在体内,B细胞工程可以获得高滴度的抗HIV bNAb(图二)。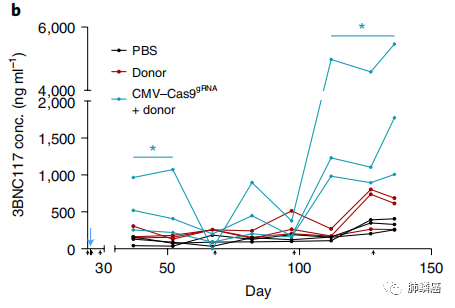
图二:不同条件下3BNC117的滴度
为了研究SHM和克隆选择,研究人员从一只注射bNAb 和saCAS9载体136天后的小鼠的肝和脾中提取DNA,并对扩增出的3BNC117 VH片段进行Illumina测序。大部分突变谱系在肝脏和脾之间共享,因此可能反映了AAV产生的异质性。这提示了体内基因工程和免疫方案已经导致了源于AAV生产的异质性或体内SHM变异体的变异克隆性扩增。这表示了工程B细胞在生发中心进行克隆性扩增。
为了评估体内工程方法可能产生的脱靶效应,团队首先量化了bNAb盒在各种组织中的拷贝数。第37天肝脏中有高拷贝数的bNAb盒,而在第136天时,bNAb盒的水平仅下降了10倍,这反映了AAV episomes在肝脏中的高度保留。从第37天到第136天,骨髓中的AAV拷贝数显著增加,在淋巴结中也发现了不明显的类似趋势,表明3BNC117表达的细胞可能在这些组织中积累。随后,课题组使用来自治疗小鼠和阴性对照小鼠的肝和脾的gDNA,对四个潜在的脱靶位点以及靶点上的gDNA进行了靶向测序。与未经处理的小鼠脾中的对照DNA相比,更高的突变率趋势表明CRISPR-Cas9诱导的双链DNA断裂容易错误修复,这在肝脏中很明显,在脾中没有此情况,并且只在IgH靶点上。这体现了CRISPR-Cas9切割是高度序列特异性的,但也发生在不想要的组织中。在CRISPR-Cas9介导的靶向整合之前,B细胞和非B细胞都可以表达膜上的抗体,但只有B细胞在抗原结合后增殖(图三)。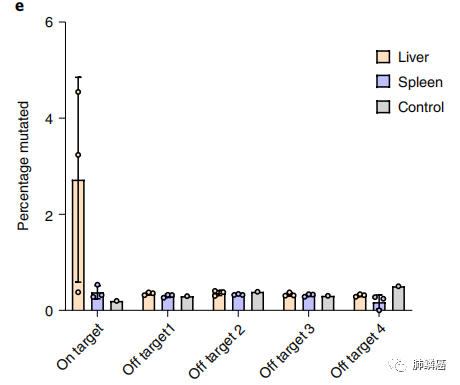
图三:四个潜在的脱靶位点以及靶点上的gDNA的突变率
为避免CRISPR-Cas9切割发生在不想要的组织中所造成的不安全性,课题组接下来在CD19(B细胞特异性启动子)的控制下编码saCas9。用20微克HIV gp120免疫C57BL/6小鼠,6天后,每只小鼠共注射一个由CD19启动子调控的saCas9载体和同时编码bNAb和sgRNA的载体。这些小鼠均接受了多达六次额外的免疫接种。在四次免疫后,接受治疗的小鼠血液中已有高含量的3BNC117 bNAb。且在第四次免疫后45天,ELISPOT显示骨髓中可以检测到类似的3BNC117分泌。因此,替换saCas9启动子并不影响治疗效果(图四)。
为了评估对生物分布和安全性的可能影响,在与供体+sgRNA载体和编码saCas9的第二种载体,且在普遍存在的启动子或B细胞特异性CD19启动子的控制下共注射3天后,不同组小鼠被安乐死进行组织分析。在CD19或脾病灶形成病毒(SFFV)启动子的调控下,编码saCas9的载体均获得了相似的转导速率。然而,CD19启动子显著降低肝脏中saCas9的表达,而不降低外周血单核细胞中的表达。分离两个AAVs之间的saCas9和sgRNA的编码,并在B细胞特异性启动子下表达saCas9,可将不必要的切割降低到检测下限以下,同时达到免疫后3BNC117的高滴度(图五)。
图四:B细胞特异性启动子CD19的控制下,3BNC117 bNAb的分泌情况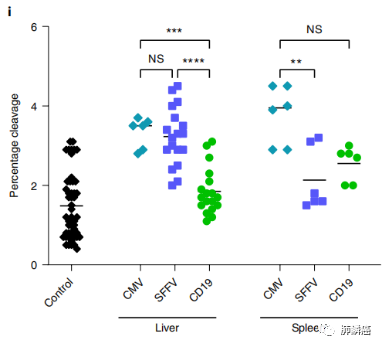
图五:利用CMV、SFFV或CD19驱动的saCas9表达对指定组织中靶向切割分析
图片
2022年1月5日,来自美国斯克里普斯研究所的Michael Farzan课题组在Molecular Therapy上发表题为Reprogramming of the heavy-chain CDR3 regions of a human antibody repertoire的研究性文章。该文章发现并鉴定了一种Cas12a同源物,可识别人类JH基因中存在的PAM基序、并在重组重链的DJ结附近引入双链断裂,同时描述了一种用短的同源定向修复模板(HDRT)替换基因组区域的优化方法。
简评
本文所示的B细胞工程提供了表达获得性免疫所需的治疗性抗体的机会。该工程B细胞可以在体内安全并长期进行工作。与体外工程相比,体内B细胞工程更加简单、快速、经济。然而,为进一步提高安全性,也可以通过使用更特异的核酸酶以减少靶外整合的表达。无论如何,该体内B细胞工程具有极强的未来研究意义以及广泛的未来应用,这可能是治疗其他持续性感染以及治疗自身免疫性疾病、遗传疾病和癌症的潜在方法。
原文链接:
doi: 10.1038/s41587-022-01328-9.
参考文献:
1.Nahmad, AD., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nat Biotechnol. June 9, 2022.
2.Ou, T., et al., Reprogramming of the heavy-chain CDR3 regions of a human antibody repertoire. Mol Ther. Jan 5, 2022.




