2022年9月9日,在Lancet(IF 54.4) 杂志发表了: 阿替利珠单抗辅助治疗风险增加的术后肾癌研究数据,题目为:“Adjuvant atezolizumab versus placebo for patients with renal cell carcinoma at increased risk of recurrence following resection (IMmotion010): a multicentre, randomised, double-blind, phase 3 trial”。研究结果显示:阿替利珠单抗和安慰剂的中位DFS分别57.2和49.5个月,没有证据表明临床结果有所改善 。接下来详细的看一下这项研究。

研究背景
局部区域肾细胞癌的标准治疗是手术,但许多患者会复发。本研究的目的是确定在切除术后复发风险增加的患者中,阿替利珠单抗辅助治疗(与安慰剂相比)能否延迟复发。
研究方法
IMmotion010是一项随机、双盲、多中心、3期试验,在28个国家的215个中心进行。患者纳入标准为年龄≥18岁,患有透明细胞或肉瘤样成分的肾细胞癌,并且复发风险增加的患者。接受肾切除术(联合或不联合转移灶切除术)后,患者被随机分配(1∶1)接受每3周1次阿替利珠单抗(1200 mg)或安慰剂(均为静脉给药)治疗,治疗16个周期或1年。通过交互式语音网络应答系统进行随机分组。分层因素包括疾病分期(T2或T3a vs T3b-c或T4或N+ vs M1,无疾病证据)、地理区域(北美[不包括墨西哥] vs 世界其他地区)和肿瘤浸润免疫细胞的PD-L1状态(表达<1% vs表达≥1%)。主要终点是研究者在意向治疗人群中评估的无病生存期(DFS),意向治疗人群定义为所有被随机分组的患者,无论是否接受了研究治疗。可评价安全性的人群包括所有被随机分配到治疗组并接受任何剂量的研究药物(即阿替利珠单抗或安慰剂)的患者,无论接受的是全剂量还是部分剂量。
研究结果
2017年1月3日至2019年2月15日,共纳入778例患者。390例(50%)被分配至阿替利珠单抗组,388例(50%)被分配至安慰剂组。在数据截止日期(2022年5月3日),中位随访时间为44.7个月(IQR 39.1 ~ 51.0)。
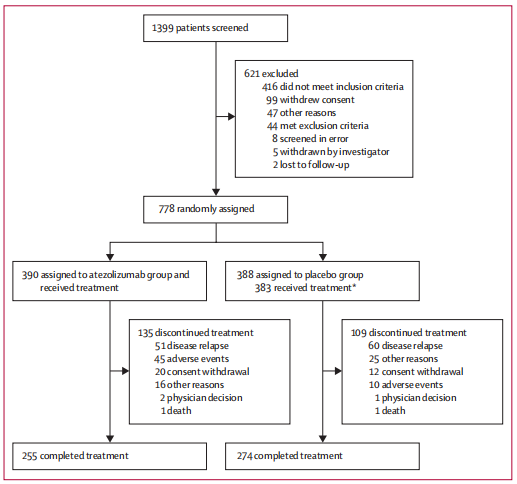
图1. 研究概况
研究者评估阿替利珠单抗组和安慰剂组的中位DFS分别为57.2个月(95% CI 44.6 ~不可评估)和49.5个月(47.4 ~不可评估)(风险比0.93,95% CI 0.75 ~ 1.15, p= 0.50)。
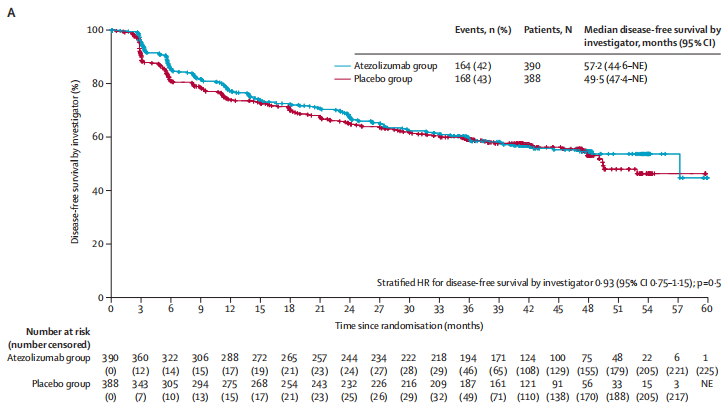
图2. DFS结果
最常见的3 ~ 4级不良事件包括高血压(阿替利珠单抗组7例[2%]vs安慰剂组15例[4%])、高血糖(10例[3%]vs 6例[2%])和腹泻(2例[1%]vs 7例[2%])。阿替利珠单抗组69例患者(18%)和安慰剂组46例患者(12%)发生了严重不良事件。无治疗相关死亡。
研究结论
对于复发风险增加的肾细胞癌患者,阿替利珠单抗作为切除术后的辅助治疗,与安慰剂相比,没有证据表明临床结果有所改善。这些研究结果不支持辅助阿替利珠单抗治疗肾细胞癌。
来源:https://pubmed.ncbi.nlm.nih.gov/36099926/




