一年一度的肿瘤学术盛会美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会如期举行,作为临床肿瘤领域最具权威性的会议,很多重磅研究改变或即将改变临床实践。
现列举部分重要研究结果和各位肿瘤医生分享,希望能借此和各位读者一起探讨肿瘤治疗的发展趋势。
开创“HER2低表达”新分型
本届ASCO年会上最引人瞩目的研究当属DESTINY-Breast04[1]。之前根据HER2状态,将乳腺癌分为HER2阳性和HER2阴性,而DESTINY-Breast04研究证实HER2低表达(免疫组化1+或2+/原位杂交阴性)同样是一种具有临床意义的分型。
这是一项Trastuzumab Deruxtecan(T-DXd)对比医师选择治疗用于HER2低表达晚期乳腺癌的随机Ⅲ期研究。557例接受过1~2线治疗的HER2低表达晚期乳腺癌患者随机接受T-DXd或医师选择化疗治疗,主要终点是激素受体(Hormone Receptor, HR)阳性患者的无进展生存期(Progression-Free Survival, PFS)。
结果显示HR阳性患者中,两组中位PFS分别是10.1个月 vs 5.4个月(HR 0.51,P<0.0001)。全体患者中,两组中位PFS分别是9.9个月 vs 5.1个月(HR 0.50,P<0.0001)(图1)。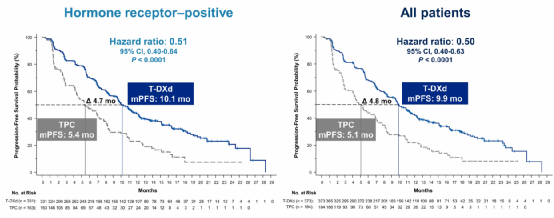
图1 HR阳性和全体患者的PFS
总生存(Overall Survival, OS)同样显示出显著获益。HR阳性患者中,两组中位OS分别是23.9个月 vs 17.5个月(HR 0.64,P=0.0028)。全体患者中,两组中位OS分别是23.4个月 vs 16.8个月(HR 0.64,P=0.0010)(图2)。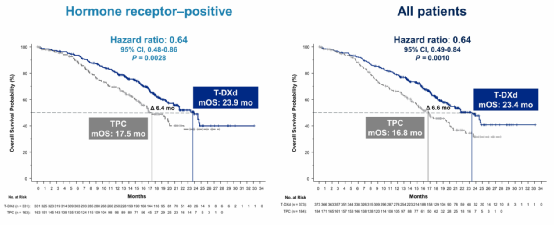
图2 HR阳性和全体患者OS
HER2低表达患者约占全部乳腺癌患者的50%。DESTINY-Breast04是第一项证实在HER2低表达乳腺癌中,抗HER2治疗对比标准治疗可显著改善患者PFS和OS的研究。研究开创性证实HER2低表达晚期乳腺癌患者是一类可以通过靶向治疗获益的人群,半数乳腺癌患者的治疗将随之改变,而T-DXd则成为这类患者新的标准治疗。
PD-1抑制剂可以作为局部晚期直肠癌的根治手段吗?
目前局部晚期直肠癌的全程新辅助治疗(Total Neoadjuvant Therapy, TNT)包括化疗,放疗和手术,反应良好的患者有机会豁免放疗和手术。对于具有错配修复缺陷(Mismatch Repair Deficient, dMMR)的晚期直肠癌患者来说,免疫单药是高度有效的治疗方式。一项研究探索了免疫治疗在局部晚期直肠癌患者中替代化疗和豁免放疗及手术的可能[2]。
研究入组Ⅱ~Ⅲ期dMMR直肠癌患者,接受为期6个月的PD-1抑制剂Dostarlimab治疗,根据治疗反应决定后续治疗,达到临床完全缓解(Clinical Complete Response, cCR)的患者可免于后续放疗和手术,未达到的患者则继续行标准治疗。主要终点是PD-1抑制剂±化放疗的总反应率(Overall Response Rate, ORR)。
结果显示目前完成6个月治疗的14例患者全部达到cCR。没有患者需要后续化疗,放疗或手术。最初4例患者反应持续时间(Duration of Response, DoR)已经超过2年,尚未观察到疾病复发(图3)。无3~4级不良事件(Adverse Events, AEs)发生。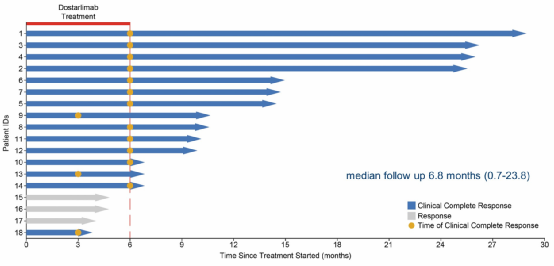
图3 患者治疗反应
因此,单一免疫治疗有望成为局部晚期dMMR直肠癌患者的治愈方式,有可能开启一种全新的根治性治疗模式。对于早期直肠癌来说,生物标志物驱动临床影响力开始凸显。目前研究已经同步发表于《新英格兰医学杂志》(The New England Journal of Medicine)。
抗EGFR和抗VEGF之争
抗EGFR和抗VEGF靶向治疗可为RAS野生型转移性结直肠癌(Metastatic Colorectal Cancer, mCRC)患者带来约30个月的生存获益。但是RAS野生型患者中,首选的靶向治疗还不清楚。SWOG 80405研究显示西妥珠单抗和贝伐珠单抗可带来类似的OS,而FIRE-3研究显示西妥昔单抗对比贝伐珠单抗可改善此类患者的OS。
PARADIGM研究[3]探索了RAS野生型左半CRC患者中帕尼单抗和贝伐珠单抗联合标准治疗的优劣。初治RAS野生型mCRC患者随机接受帕尼单抗+mFOLFOX6或贝伐珠单抗+mFOLFOX6治疗,主要终点是左半mCRC患者的OS,如果具有显著性,继续在全人群中分析OS。
结果显示左半CRC患者中,两组中位OS分别是37.9个月 vs 34.3个月,达到显著性差异(HR 0.82,P=0.031)(图4)。全人群中,两组中位OS分别是36.2个月 vs 31.3个月(HR 0.84,P<0.05)(图5)。
图4 左半mCRC患者OS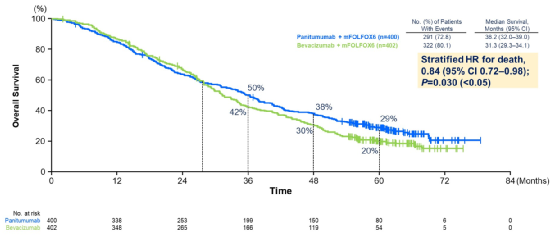
图5 全体患者OS
左半mCRC患者中两组中位PFS分别是13.7个月 vs 13.2个月(HR 0.98),ORR 80.2% vs 68.6%;全体患者中位PFS 12.9个月 vs 12.0个月(HR 1.01),ORR 74.9% vs 67.3%。帕尼单抗组反应深度更大。
PARADIGM研究达到主要终点,证实了左半和全体RAS野生型mCRC患者中,一线抗EGFR较抗VEGF更具有疗效优势。两方案PFS可比,但是帕尼单抗组的反应率和R0切除率均更高。因此,帕尼单抗+化疗可作为RAS野生型mCRC患者的一线标准治疗方案。
晚期胰腺癌治疗新方案
约10%~15%的胰腺癌为KRAS野生型,目前还缺乏有效治疗。中国学者秦叔逵教授在大会上报告一项EGFR单克隆抗体尼妥珠单抗联合化疗用于KRAS野生型晚期胰腺癌治疗的NOTABLE Ⅲ期研究结果[4]。
初治KRAS野生型晚期胰腺癌患者随机接受尼妥珠单抗+吉西他滨或安慰剂+吉西他滨治疗,主要终点是OS。结果显示两组中位OS分别是10.9个月 vs 8.5个月(HR 0.50,P=0.024)(图6)。两组中位PFS分别是4.2个月 vs 3.6个月(HR 0.56,P=0.013)。AE发生率类似。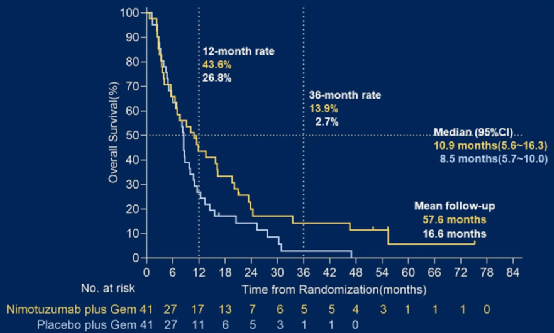
图6 NOTABLE研究OS
尼妥珠单抗联合吉西他滨可显著改善晚期胰腺癌患者的结局,为靶向治疗进展乏力的胰腺癌提供了一种新的治疗方案。目前晚期胰腺癌的标准治疗方案为吉西他滨+白蛋白紫杉醇或FOLFIRINOX等联合方案,期待尼妥珠单抗联合这些化疗方案的疗效。
戈沙妥珠单抗改善HR+/HER2-晚期乳腺癌患者的PFS
内分泌治疗+CDK4/6抑制剂是HR+/HER2-晚期乳腺癌患者的标准治疗。内分泌治疗耐药后,化疗是患者的治疗选择。戈沙妥珠单抗是一种Trop-2抗体偶联药物(Antibody-Drug Conjugate, ADC),目前已经是三阴性乳腺癌的标准治疗方案。TROPiCS-02研究[5]探索了戈沙妥珠单抗用于HR+/HER2-患者的疗效。
研究入组至少一线内分泌治疗、紫杉类和CDK4/6抑制剂治疗后进展的患者,随机接受戈沙妥珠单抗或医师选择方案治疗。主要终点是PFS。
结果显示两组的中位PFS分别是5.5个月 vs 4.0个月(HR 0.66,P=0.0003)(图7)。OS数据还不成熟,中期分析显示两组中位OS分别是13.9个月 vs 12.3个月(HR 0.84,P=0.14)。两组ORR分别是21% vs 14%。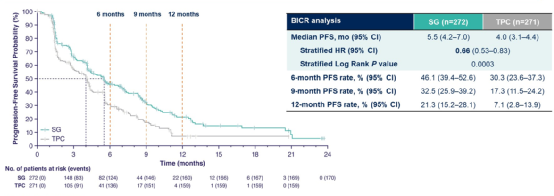
图7 TROPiCS-02研究PFS
研究达到主要终点,戈沙妥珠单抗可显著改善经治HR+/HER2-乳腺癌患者的PFS,且ORR更高。目前OS无显著差异,还需要进一步随访。戈沙妥珠单抗有望为内分泌耐药HR+/HER2-乳腺癌患者带来一种新的治疗选择。
复发难治性难治性尤文肉瘤治疗新方案
尤文肉瘤相对少见,目前复发难治性尤文肉瘤缺乏标准方案,也缺乏相关随机对照研究。ASCO上公布的rEECur研究[6]使得人们对这种少见肿瘤给予了更多关注。
研究是一项多臂、多阶段设计研究。4组方案中,有2组方案因疗效不佳而不再继续研究,后续仅探索了拓扑替康+环磷酰胺(TC)和大剂量异环磷酰胺(IFOS)的疗效。主要终点为无事件生存期(Event-Free Survival, EFS)。
中位随访47个月,整个队列的中位PFS 4.9个月,中位OS 14.7个月。TC组中位EFS 3.5个月,IFOS组中位EFS 5.7个月(图8)。TC组中位OS 10.5个月,IFOS组中位OS 15.4个月(图9)。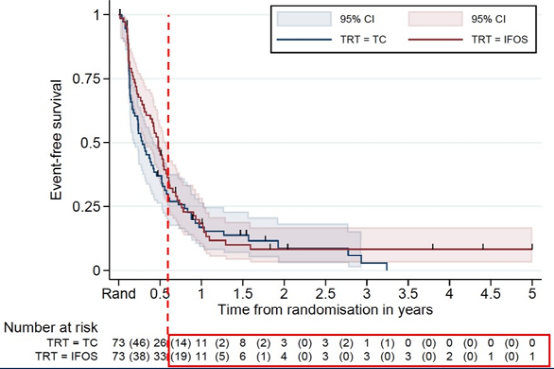
图8 rEECur研究EFS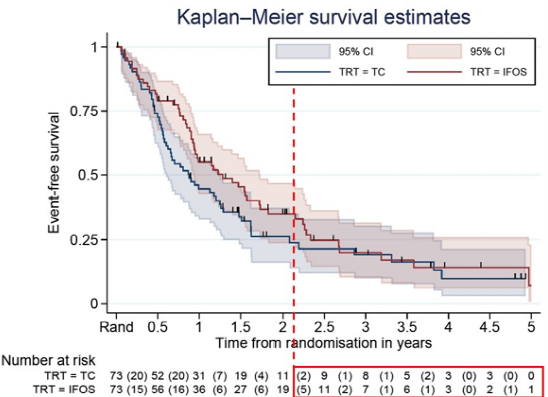
图9 rEECur研究OS
但是由于IFOS需要持续输注,毒性也更高,TC组和IFOS组因毒性而终止治疗的比例分别是0 vs 26%。
这种少见肿瘤终于有了来自于随机研究带来的治疗疗效和毒性数据。研究显示IFOS较TC方案具有更佳的EFS和OS结果,并可能对于儿童患者来说更有效。研究初次树立了复发难治疾病的标准治疗方案。研究将继续招募患者和引入其他新型方案,为患者带来更多治疗希望。
PD-L1高表达患者,应该接受免疫治疗还是免疫联合化疗?
对于PD-L1≥50%的晚期非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)患者,免疫单药就可以获得良好的治疗效果。而加入化疗是否可以进一步改善疗效还存在争议。本次ASCO上公布了一项汇总分析,比较了免疫单药和联合治疗的优劣[7]。
研究汇总了在PD-L1 TPS≥50%、驱动基因阴性的晚期NSCLC患者中进行的免疫研究(表1),对比患者接受免疫联合化疗和单纯免疫治疗的OS。
表1 纳入研究情况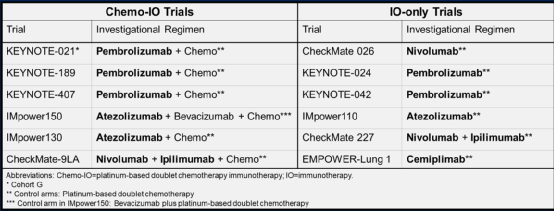
分析结果显示化疗联合免疫和免疫单药的中位OS分别是25.0个月 vs 20.9个月(HR 0.82)(图10),中位PFS分别是9.6个月 vs 7.1个月(HR 0.69)(图11),ORR分别是61% vs 43%(OR 1.2)。亚组分析显示除了≥75岁患者外,各亚组获益更偏向于免疫联合化疗组。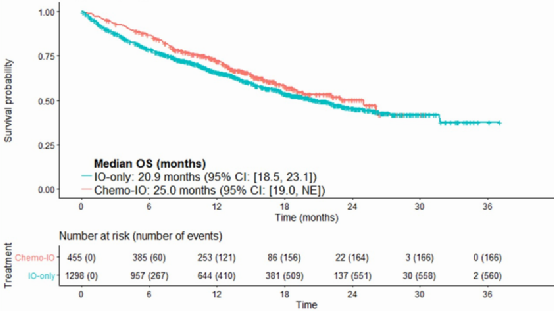
图10 OS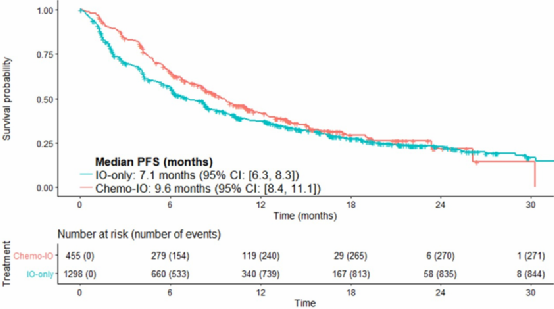
图11 PFS
研究显示对于PD-L1高表达患者,免疫联合化疗似乎具有更好的疗效,而75岁以上患者接受免疫单药治疗具有更好的PFS和OS。需要注意研究并非头对头前瞻性比较,仅可为临床选择提供一些参考。决策时还是应该个体化综合考虑风险和获益。
TIGIT抑制剂再次失利小细胞肺癌
PD-1/PD-L1抑制剂的开发已经势如强弩之末,新型免疫药物成为下一个赛场。TIGIT是一种新型免疫检查点,和PD-1表达具有高度相关性,并在前期研究中显示出和PD-1/PD-L1抑制剂的协同作用。然而之前被广泛关注的SKYSCRAPER-02研究[8]结果却令人大跌眼镜。
这是一项探索TIGIT抑制剂Tiragolumab用于广泛期小细胞肺癌(Small Cell Lung Cancer, SCLC)的Ⅲ期研究。初治广泛期SCLC患者随机接受Tiragolumab或安慰剂联合阿替利珠单抗+化疗治疗,主要终点是无脑转移患者的OS和PFS。
结果显示无脑转移患者中,两组中位PFS分别是5.4个月 vs 5.6个月(HR 1.11,P=0.3504)(图12),中位OS均为13.6个月(HR 1.04,P=0.7963)(图13)。Tiragolumab加入标准治疗没有带来临床获益。同时安全性良好,也未显著增加毒性。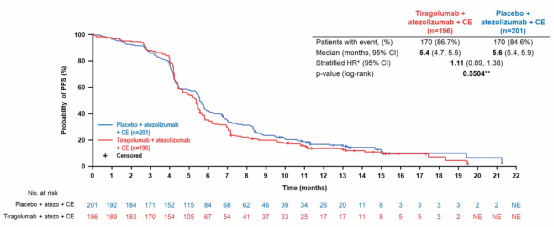
图12 SKYSCRAPER-02研究PFS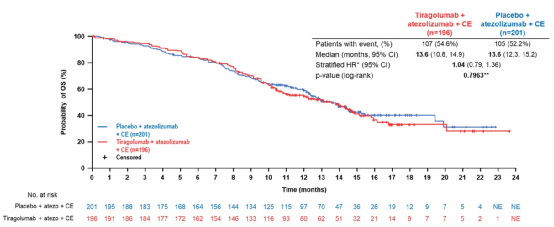
图13 SKYSCRAPER-02研究OS
曾经备受瞩目的免疫新秀先后在非小细胞肺癌和SCLC治疗中折戟。究竟是靶点抑制确实无效,生物标志物选择错误还是不同瘤种中具有不同表现需要进一步分析。期待失败中能够获得宝贵的启示,同时也期待药物在食管癌中的表现。
参考文献:
[1] Shanu Modi, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): Results of DESTINY-Breast04, a randomized, phase 3 study. ASCO 2022 abstr LBA3.
[2] Andrea Cercek, et al. Single agent PD-1 blockade as curative-intent treatment in mismatch repair deficient locally advanced rectal cancer. ASCO 2022 abstr LBA5.
[3] Takayuki Yoshino, et al. Panitumumab (PAN) plus mFOLFOX6 versus bevacizumab (BEV) plus mFOLFOX6 as first-line treatment in patients with RAS wild-type (WT) metastatic colorectal cancer (mCRC): Results from the phase 3 PARADIGM trial. ASCO 2022 abstr LBA1.
[4] Shukui Qin, et al. Nimotuzumab combined with gemcitabine versus gemcitabine in K-RAS wild-type locally advanced or metastatic pancreatic cancer: A prospective, randomized-controlled, double-blinded, multicenter, and phase III clinical trial. ASCO 2022 abstr LBA4011.
[5] Hope S. Rugo, et al. Primary results from TROPiCS-02: A randomized phase 3 study of sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (Pts) with hormone receptor–positive/HER2-negative (HR+/HER2-) advanced breast cancer. ASCO 2022 abstr LBA1001.
[6] Martin McCabe, et al. Phase III assessment of topotecan and cyclophosphamide and high-dose ifosfamide in rEECur: An international randomized controlled trial of chemotherapy for the treatment of recurrent and primary refractory Ewing sarcoma (RR-ES). ASCO 2022 abstr LBA2.
[7] Oladimeji Akinboro, et al. Outcomes of anti–PD-(L)1 therapy with or without chemotherapy (chemo) for first-line (1L) treatment of advanced non–small cell lung cancer (NSCLC) with PD-L1 score ≥ 50%: FDA pooled analysis. ASCO 2022 abstr 9000.
[8] Charles M. Rudin, et al. SKYSCRAPER-02: Primary results of a phase III, randomized, double-blind, placebo-controlled study of atezolizumab (atezo) + carboplatin + etoposide (CE) with or without tiragolumab (tira) in patients (pts) with untreated extensive-stage small cell lung cancer (ES-SCLC). ASCO 2022 abstr LBA8507.




