多发性骨髓瘤,好发于60岁以上的老年人,虽然是一种罕见的疾病,但却是第二常见的血液系统恶性肿瘤。通常可表现为骨痛,全身乏力不适,反复上呼吸道感染,感知异常、下肢无力等,此外,还会引起轻链淀粉样变,从而导致肾衰竭等(图1)。
图1 多发性骨髓瘤临床表现(图源网络)
通过免疫调节等药物的使用,患者的中位生存时间得到了显著提高,但是老年患者的多发性骨髓瘤容易复发且难治,提高其生存率还是一个巨大的挑战[1]。而2021年新增的国家医保药品包含了3款治疗多发性骨髓瘤的药物,这为减轻老年人血液癌症的治疗负担提供了极大的保障。
多发性骨髓瘤的致病机理
多发性骨髓瘤是一种源自骨髓的浆细胞恶性肿瘤;它是一种克隆性浆细胞疾病,会产生过量的单克隆免疫球蛋白(图2)。此前的一些研究认为单克隆丙种球蛋白病随着病情加重会逐渐进展为多发性骨髓瘤,二代测序的研究进一步揭示了基因组变异对该疾病发病机制的贡献[2]。
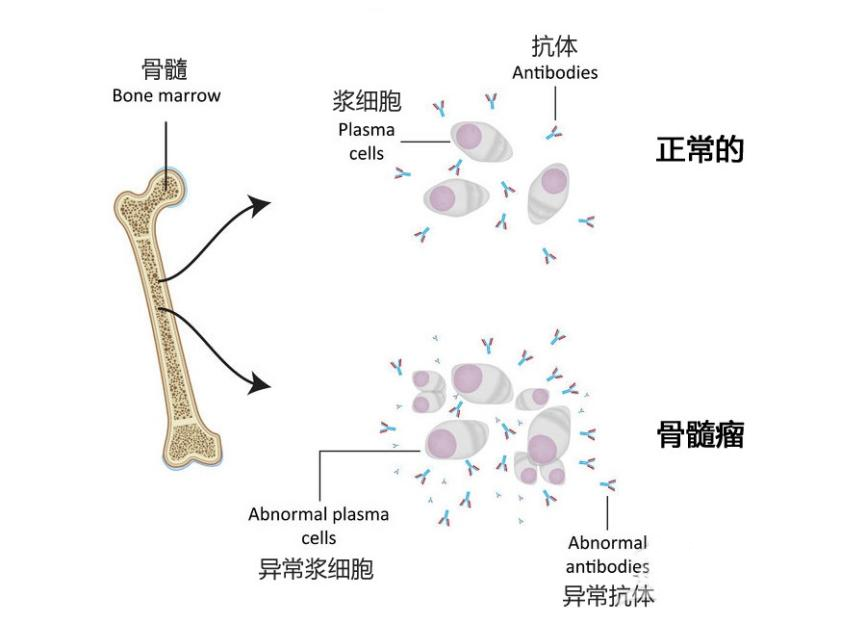
图2 多发性骨髓瘤的示意图(图源网络)
为了解多发性骨髓瘤的致病机理,我们得首先明确浆细胞的来源及免疫球蛋白的产生过程(图3)。浆细胞是B细胞谱系的终末分化细胞,它们经历了体细胞超突变和类别转换重组,在此过程中会暴露于同源抗原从而获得了产生特异性免疫球蛋白的能力。
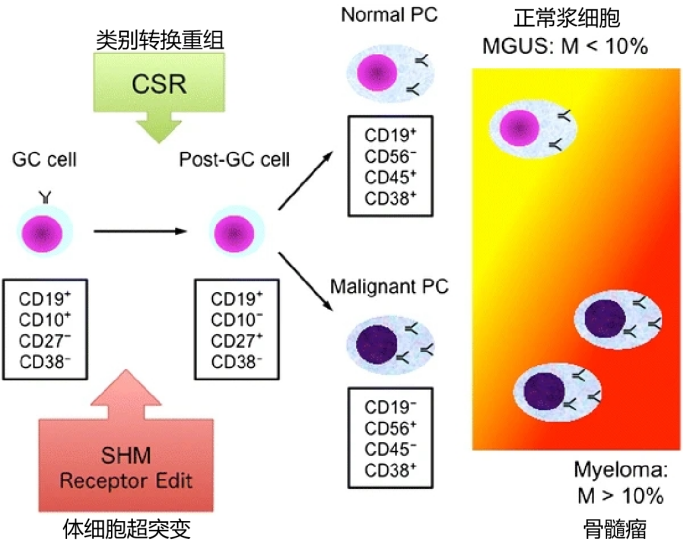
图3 B细胞分化和转化为骨髓瘤过程中表面标志物的表达模式
通过二代测序发现,在基因组14q32处产生涉及免疫球蛋白重链 (IgH) 位点的染色体易位,或者发生超二倍体,这些基因改变可影响细胞周期蛋白D,从而使休眠浆细胞或记忆B细胞在细胞周期G1/S期获得生长优势,进一步发展为骨髓瘤。
此外还通过二代测序检测到K-Ras和N-Ras的点突变频率在单克隆丙种球蛋白病进展为多发性骨髓瘤的过程中显著提高。而Ras和Myc的活化会介导骨髓中恶性浆细胞数量的大量增加,使在单克隆丙种球蛋白病进展为多发性骨髓瘤。NF-κB 可使骨髓瘤细胞不依赖于基质的生长,具有更高的致病性。二代测序也检测到编码NF-κB通路抑制剂的基因的纯合缺失。
多发性骨髓瘤的治疗方案
在多发性骨髓瘤的治疗中,会基于细胞遗传学定义多发性骨髓瘤的高危和标危情况,一些细胞遗传学异常,如t(4;14)等被确定为预后不良,这些异常患者的预后可能因治疗选择而异。因此,在评价不同治疗方法的过程中需仔细分析细胞遗传学亚群[3]。
2020 版《中国多发性骨髓瘤诊治指南》,分别从六大部分临床表现;诊断标准、分型、分期;鉴别诊断;预后评估与危险分层;疗效评估;MM 的治疗与随访更新并完善了旧版指南,使中国诊治水平越来越接近国际水准。
蛋白酶抑制剂和免疫调节药物已显著提高多发性骨髓瘤患者的生存率。然而,多发性骨髓瘤患者最终对这两类药物产生耐药性,因此在快速发展的治疗环境中,越来越多的新药被研发并更新在多发性骨髓瘤的治疗指南中。而且,考虑到多发性骨髓瘤的耐药复发,修订诊治指南时会偏重于增添了更多医保可报销的药物。
三代免疫调节剂治疗多发性骨髓瘤
三代免疫调节剂是继沙利度胺和来那度胺后的第三款治疗多发性骨髓瘤的免疫调节剂。泊马度胺就是正大天晴生产的第三代免疫调节剂,已被列入2021年医保名录。
泊马度胺作为最新的免疫调节剂,已显示出显着的体外抗增殖和促凋亡作用。体内研究表明,来那度胺和泊马度胺之间的交叉耐药性有限,而且泊马度胺在复发难治的多发性骨髓瘤患者中包括那些对来那度胺和硼替佐米均难治的患者,发挥了重要的作用。有几项研究评估了泊马度胺不同剂量、不同时间以及联合不同药物的使用效果,发现与高剂量地塞米松或单用泊马度胺相比,泊马度胺加低剂量地塞米松显示出更好的疗效反应、无事件生存率和总生存率。随后还研究泊马度胺联合烷基化剂、蒽环素、蛋白酶体抑制剂等药物治疗的试验。确定其作为难治复发型骨髓瘤的治疗药物。
历史上将度胺类药物用于免疫调节剂治疗多发性骨髓瘤是经过了曲折探索的[4]。德国制药公司Chemie Grünenthal于1957年10月1日将沙利度胺作为镇静剂引入市场,并大量用于治疗孕期晨吐,随后的研究证明其与严重的胎儿畸形相关。在其致畸特性被发现后不久,重要的是要注意到沙利度胺被认为是一种可能的癌症治疗方法。后又发现沙利度胺具有显著抗血管生成特性。因此,1997年,沙利度胺作为“同情用药”用于治疗骨髓瘤患者,值得注意的是,32%的患者对沙利度胺有反应,这使其成为30多年来第一个单药治疗骨髓瘤的新药。
CD38抗体靶向药治疗多发性骨髓瘤
Daratumumab是杨森/强生公司研发的国内首个获批的CD38抗体靶向药,主要用于治疗复发型及难治性多发性骨髓瘤,被纳入2021年医保目录。
CD38 是一种具有胞外酶活性的跨膜糖蛋白,还具有受体和粘附分子的功能,在多发性骨髓瘤细胞上一致的高表达,在正常淋巴和骨髓细胞以及一些非造血来源的组织中表达水平相对较低[5]。
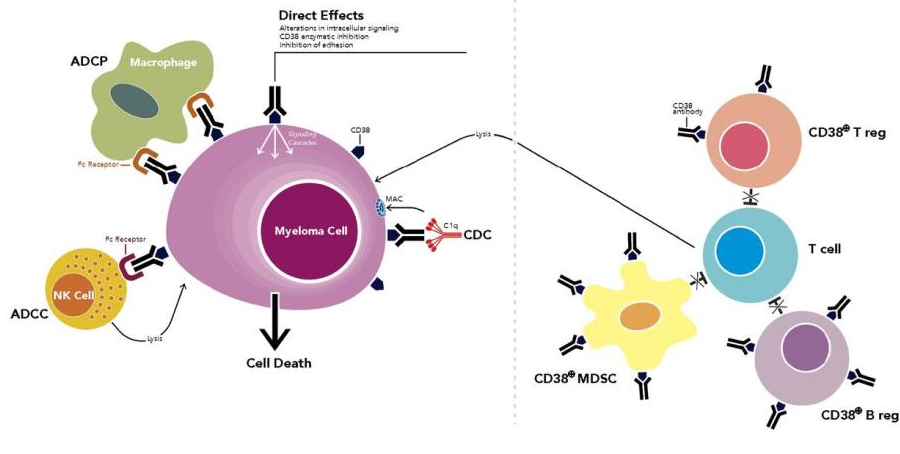
图4 DOI: 10.1182/blood-2017-06-740944
针对CD38研发靶向抗体可治疗多发性骨髓瘤。其中有几个比较重要的机制[6](图4),首先,可通过靶向抗体的Fc段与人体多种免疫细胞或因子结合,发挥杀伤多发性骨髓瘤细胞的作用,其中结合巨噬细胞被称为抗体依赖性细胞吞噬作用 (ADCP),结合NK细胞被称为抗体依赖性细胞毒性 (ADCC),以及结合补体的补体依赖性细胞毒性 (CDC)。其次,CD38靶向抗体还可直接诱导细胞凋亡,抑制CD38胞外酶功能发挥抗肿瘤活性。最后,CD38靶向抗体具有免疫调节作用,通过清除CD38+ Tregs、Bregs和MDSC,导致CD4+和CD8+T细胞扩增,并产生更好的宿主抗肿瘤免疫反应。
作者:S.Yi
来源:临床前线
参考资料
[1] Kazandjian, Dickran. Multiple Myeloma Epidemiology and Survival, a Unique Malignancy[J]. Seminars in Oncology, 2016:676.
[2] Furukawa Y , Kikuchi J . Molecular pathogenesis of multiple myeloma[J]. International Journal of Clinical Oncology, 2015, 20(3):413-422.
[3] Sonneveld P , Avet-Loiseau H , Lonial S , et al. Treatment of Multiple Myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group[J]. Blood, 2016, 127(24):2955-2962.
[4] Robert A , Kyle, Vincent S , et al. Multiple myeloma.[J]. Blood, 2008.
[5] Deaglio S, Mehta K, Malavasi F. Human CD38: a (r)evolutionary story of enzymes and receptors. Leuk Res. 2001;25(1):1-12.
[6] Niels W.C.J. van de Donk, Richardson P G , Malavasi F . CD38 antibodies in multiple myeloma: Back to the future[J]. Blood, 2017, 131(1):blood-2017-06-740944.




